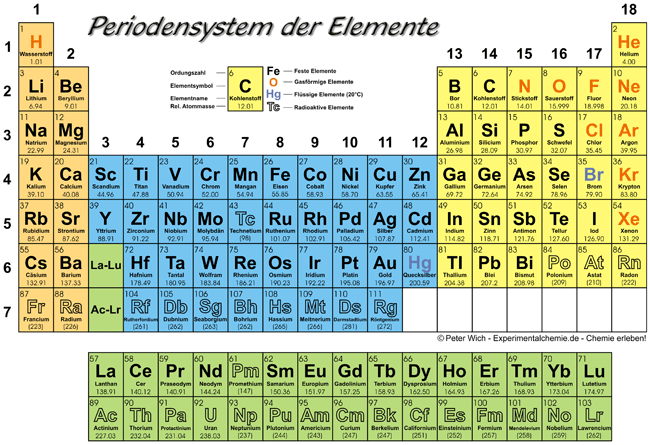
 Das Periodensystem der Elemente (kurz Periodensystem oder PSE) stellt alle chemischen Elemente mit steigender Kernladung (Ordnungszahl) und entsprechend ihrer chemischen Eigenschaften eingeteilt in Perioden sowie Haupt- und Nebengruppen dar.
Das Periodensystem dient heute vor allem der Übersicht. Historisch
war es für die Vorhersage der Entdeckung neuer Elemente bzw. deren
Eigenschaften sehr wichtig. DarstellungNachstehend ist das Periodensystem in seiner heute bekanntesten Form als Langperiodensystem wiedergegeben:
- Die Elemente sind mit ihrer Ordnungszahl und ihrem Symbol aufgeführt.
- Als Perioden werden die waagrechten Zeilen oder Reihen bezeichnet,
- als Gruppen die senkrechten Spalten.
- Die Schalen beziehen sich auf das Atommodell von Niels Bohr.
(Ein über die Ordnungszahl 118 erweitertes Periodensystem befindet sich unter Erweitertes Periodensystem.)
Aufbau im Detail
Grundlagen
Sämtliche uns umgebende Materie besteht aus Atomen.
- Jedes Atom besteht aus einem Atomkern und einer Elektronenhülle.
- Jeder Atomkern
enthält positiv geladene Protonen (mindestens eines, höchstens etwas
mehr als 100), die Anzahl der Protonen wird als „Kernladungszahl“
bezeichnet und dient als „Ordnungszahl“ (OZ) für die betreffende
Atomsorte.
- Jeder Atomkern ist von einer Elektronenhülle
umgeben. Wenn diese Hülle genau so viele (negativ geladene) Elektronen
enthält, wie im zugehörigen Kern Protonen vorhanden sind, befindet sich
das Atom im „elektrisch neutralen“ Zustand, da die einander entgegen
gesetzten elektrischen Ladungen von Proton und Elektron gleich groß
sind.
- Das „Periodensystem“ bezieht sich nur auf Atome in diesem elektrisch neutralen Zustand.
- Elektronen können sich im Atom nur auf solchen Bahnen befinden, die
bestimmte Abstände vom Atomkern haben; für solche zu einem Abstand
gehörigen Bahnen wird auch der Begriff „Schale“ benutzt.
- Jede dieser Schalen bietet nur für eine ganz bestimmte Anzahl Elektronen Platz:
- In die innerste Schale passen nur zwei Elektronen, also gibt es auch nur zwei Chemische Elemente,
die nur diese innerste Elektronenschale haben, das sind die mit den
ersten beiden Ordnungszahlen: 1 (Wasserstoff) und 2 (Helium). Sie
bilden deshalb in der Darstellung des Periodensystems die oberste Reihe.
- Bei dem nächstfolgenden Atom mit drei Protonen und folglich drei
Elektronen befindet sich das dritte Elektron einzeln in einer weiter
außen liegenden Elektronenschale (Lithium mit der Ordnungszahl 3).
Diese nächste Schale hat Platz für maximal acht Elektronen. Diesem
Aufbau entsprechend werden diese acht Elemente (mit insgesamt drei bis
zehn Elektronen) im Periodensystem als nächste Reihe dargestellt. Bei
der Ordnungszahl 11 (Natrium) wird eine weitere Elektronenschale
angefangen und mit einem Elektron besetzt, hier ist wiederum für
maximal acht Elektronen Platz; somit bilden die Elemente bis zur
Ordnungszahl 18 (Argon) auch die nächstfolgende Reihe (Zeile) bei der
Darstellung im Periodensystem.
- Betrachtet man nur die Elektronen der jeweils äußersten Schale, so
spricht man von den Außenelektronen; in der innersten Schale gibt es
ein oder zwei, in den nächsten beiden ein bis acht Außenelektronen.
Vergleicht man nun die Stoffeigenschaften von Elementen mit der
gleichen Anzahl Außenelektronen (oder deren chemischen Verbindungen mit
jeweils einem beliebigen anderen Element), so finden sich viele
Übereinstimmungen, die genau darauf beruhen, dass es sich um Elemente
mit der gleichen Anzahl von Außenelektronen handelt. So sind z. B. die
Elemente mit nur dem ersten von acht Außenelektronen Alkalimetalle, die
Elemente mit sieben Außenelektronen Halogene und die mit voll
aufgefüllten Elektronenschalen Edelgase. Die Außenelektronen bestimmen
also im Wesentlichen die chemischen Eigenschaften und die wiederholen
sich periodisch, was zur Darstellung der Elemente in Reihen und ihrer
Benennung mit dem Begriff „Periode“ geführt hat. Die einander ähnlichen
Elemente stehen somit im Periodensystem untereinander und bilden
jeweils eine „Gruppe“; das gilt auch für die jeweils darunter stehenden
weiteren Elemente; bei den bisher besprochenen Spalten handelt sich um
die Hauptgruppen.
- Diese Systematik des Aufbaus wird in den höheren Perioden
unterbrochen. In den nächsten beiden Perioden bilden zwar auch zunächst
die ersten beiden Elektronen eine neue äußere Schale; bevor dort jedoch
das dritte bis achte Elektron hinzu kommt, wird zunächst eine darunter
liegende neue Elektronenschale mit zehn Plätzen gebildet und aufgefüllt
(OZ 21 bis 30 und 39 bis 48); hier untereinander stehende Elemente
werden Nebengruppen genannt.
- In den dann folgenden beiden Perioden entsteht sogar zunächst eine
noch tiefer liegende (drittäußerste) Schale mit 14 Plätzen (OZ 57 bis
71 und 89 bis 103); der Einbau der jeweils zusätzlichen Elektronen in
so tief liegende Schalen führt – erwartungsgemäß - dazu, dass diese
Elemente auch untereinander sehr ähnlich sind.
- Die Anordnung der Atome im Periodensystem ist somit vollständig durch die Elektronenkonfiguration erklärbar.
Anmerkungen:
Jeder Atomkern - bis auf das Wasserstoff-Isotop 1H - enthält elektrisch ungeladene Neutronen, die aber für den Aufbau des Periodensystem keine Rolle spielen. Sie werden in der „Isotopentabelle“ (und Details zu jedem Nuklid in der „Liste der Isotope“) dargestellt.Da die Elektronen an der Gesamtmasse nur einen verschwindend
kleinen Anteil haben, ist nur die Masse der Protonen und Neutronen
zusammen maßgeblich für die Atommasse;
letztere (früher „Atomgewicht“ genannt) ist in Periodensystemen oft mit
angegeben, spielt aber für dessen Aufbau ebenfalls keine Rolle.
Zusätzliche Informationen im PSE
Im Periodensystem kann man feststellen, dass einige Eigenschaften
der Elemente sich in bestimmten Positionen und Bereichen im
Periodensystem und im Periodensystem finden bzw. darstellen lassen:
- Masse – nimmt von oben nach unten und von links nach rechts zu (Ausnahmen: Ar vor K, Te vor I, Co vor Ni, Th vor Pa)
- Atomradius – nimmt von oben nach unten zu, von links nach rechts ab (bei Hauptgruppenelementen)
- Elektronegativität – nimmt von oben nach unten ab, von links nach rechts zu (Ausnahme: Edelgase)
- Ionisierungsenergie – nimmt von oben nach unten ab, von links nach rechts zu
- Metallcharakter – nimmt von oben nach unten zu, von links nach rechts ab
- Basizität der Oxide – nimmt von oben nach unten zu, von links nach rechts ab
- Schrägbeziehungen:
- Ähnlichkeiten zwischen: Lithium – Magnesium, Beryllium – Aluminium, Bor – Silicium
- Grimmscher Hydridverschiebungssatz
- Lanthanoidenkontraktion
Als weitere Informationen, die aber mit der Elektronenkonfiguration
und daher mit der Stellung im PSE nichts zu tun haben, sind die
radioaktiven Elemente gekennzeichnet:
Das Element 82 (Blei) ist das letzte Element, welches noch stabil - also nicht radioaktiv vorkommt. Alle nachfolgenden (Ordnungszahl 83 und höher) sind ausnahmslos radioaktiv und somit instabil. Dabei ist 83 (Bismut)
ein Sonderfall oder Grenzfall mit einer extrem langen Halbwertszeit.
Auch innerhalb der Elemente 1 bis 82 sind 2 Stoffe enthalten, die
radioaktiv, also instabil sind: 43 (Technetium) und 61 (Promethium).
So bleiben tatsächlich nur 80 stabile Elemente übrig, die in der Natur
vorkommen – alle anderen sind radioaktive Elemente. Von den
radioaktiven Elementen sind nur Bismut, Thorium und Uran in größeren Mengen in der Natur vorhanden, da diese Elemente Halbwertszeiten
in der Größenordnung des Alters der Erde oder länger haben. Alle
anderen radioaktiven Elemente sind entweder intermediäre
Zerfallsprodukte des Urans und Thoriums, wie das Radium oder entstehen bei seltenen natürlichen Kernreaktionen oder durch Spontanspaltung von Uran und Thorium. Elemente mit Ordnungszahlen über 94 können nur künstlich hergestellt werden; obwohl sie ebenfalls bei der Elementsynthese in einer Supernova entstehen, wurden aufgrund ihrer kurzen Halbwertszeiten bis heute noch keine Spuren von ihnen in der Natur gefunden. Geschichte
Die Datierung der Entdeckung solcher Chemischer Elemente, die bereits seit der Frühzeit oder Antike
bekannt sind, ist nur ungenau und kann je nach Literaturquelle um
mehrere Jahrhunderte schwanken. Sicherere Datierungen sind erst ab dem 18. Jahrhundert möglich. Bis dahin waren erst 15 Elemente als solche bekannt und beschrieben (Metalle wie Eisen, Kupfer, Blei, Bismut, Arsen, Zink, Zinn, Antimon, Platin, Silber, Quecksilber und Gold oder Nichtmetalle wie Kohlenstoff, Schwefel und Phosphor).
Die meisten Elemente wurden im 19. Jahrhundert entdeckt und wissenschaftlich beschrieben. Zu Beginn des 20. Jahrhunderts waren nur noch zehn der natürlichen Elemente unbekannt. Seither wurden vor allem schwer zugängliche, oftmals radioaktive Elemente dargestellt. Viele dieser Elemente kommen nicht in der Natur vor und sind das Produkt von künstlichen Kernverschmelzungsprozessen. Erst im Dezember 1994 wurden die beiden künstlichen Elemente Darmstadtium (Eka-Platin) und Roentgenium (Eka-Gold) hergestellt.
Anfang des 19. Jahrhunderts stellte Johann Wolfgang Döbereiner erstmals einen Zusammenhang zwischen der Atommasse und den chemischen Eigenschaften einzelner Elemente fest. 1863 stellte Newlands eine nach Atommassen geordnete Tabelle der Elemente in Achtergruppen (Gesetz der Oktaven) auf. Das Periodensystem selbst wurde 1869 nahezu gleichzeitig und unabhängig voneinander von Dimitri Iwanowitsch Mendelejew (1834–1907) und Lothar Meyer (1830–1895) aufgestellt. Dabei ordneten sie ebenfalls die chemischen Elemente nach steigenden Atommassen, wobei sie Elemente mit ähnlichen Eigenschaften (Anzahl der Valenzelektronen) untereinander anordneten. Im 20. Jahrhundert wurde der Aufbau der Atome entdeckt, die Periodizität wurde durch den Aufbau der Elektronenhülle erklärt. Hilfe zum Auswendiglernen
Eine mögliche Hilfe zum Auswendiglernen der Hauptgruppenelemente sind diese Sätze:
- „Liebe Berta, Bitte Come Nie Ohne Frische Nelken!“
- „Natürlich Mögen Alle Sizilianer Paprika-Sorten Clever Angerichtet.“
- „Kein Cacadu Gafft Gerne Aus Seinem Brut-Kräfig.“
- „Robert Schrie In Schnellen Silben: Tee Ist Xertig.“
- „Cäsar Badete Lange Toll Plubbernd, Bis die Polizei Auftrat, im Rhein.“
- „Franzium ist Radio-Activ.“
Sortiert nach der Periode im Periodensystem. Die Kenntnis der Atomsymbole wird vorausgesetzt.
Nach Hauptgruppen:
- „Hallo Liebe Nadine Könntest Rabe Chemisches Fragen.“
- „Bei Maggie Cam Sehr Bald Rache.“
- „Boah! Alle Gaffen Ins Tal.“
- „Christian Sieht Gerne Sein Padderborn.“
- „Nur Pariser Asseln Sabbern Bier.“
- „Opa Schreibt Seinen Text Polnisch.“
- „Fürs Clo Brauch Ich Ata.“
- „Herr Nestles Arme Kreuzen Xenas Rundungen.“
Hier sind die künstlichen Elemente 113-118 nicht berücksichtigt
Periodensystem der EntdeckerDas Periodensystem gibt einen Überblick über die Entdecker bzw. Erzeuger der einzelnen Elemente, sofern diese bekannt sind.
| Gruppe |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
| Periode |
|
| 1 |
H
+ |
|
He
+ |
| 2 |
Li
+ |
Be
+ |
|
B
+ |
C
|
N
+ |
O
+ |
F
+ |
Ne
+ |
| 3 |
Na
+ |
Mg
+ |
|
Al
+ |
Si
+ |
P
+ |
S
|
Cl
+ |
Ar
+ |
| 4 |
K
+ |
Ca
+ |
Sc
+ |
Ti
+ |
V
+ |
Cr
+ |
Mn
+ |
Fe
+ |
Co
|
Ni
+ |
Cu
+ |
Zn
+ |
Ga
+ |
Ge
+ |
As
+ |
Se
+ |
Br
|
Kr
+ |
| 5 |
Rb
+ |
Sr
+ |
Y
+ |
Zr
+ |
Nb
+ |
Mo
+ |
Tc
+ |
Ru
+ |
Rh
+ |
Pd
+ |
Ag
+ |
Cd
+ |
In
|
Sn
+ |
Sb
+ |
Te
+ |
I
+ |
Xe
+ |
| 6 |
Cs
+ |
Ba
+ |
La*
+ |
Hf
+ |
Ta
+ |
W
|
Re
+ |
Os
+ |
Ir
+ |
Pt
+ |
Au
+ |
Hg
|
Tl
+ |
Pb
+ |
Bi
+ |
Po
+ |
At
+ |
Rn
+ |
| 7 |
Fr
+ |
Ra
+ |
Ac**
|
Rf
|
Db
|
Sg
+ |
Bh
|
Hs
|
Mt
|
Ds
|
Rg
|
Uub
+ |
Uut
+ |
Uuq
+ |
Uup
+ |
Uuh
+ |
Uus
|
Uuo
+ |
|
|
*
|
La
+ |
Ce
+ |
Pr
+ |
Nd
+ |
Pm
+ |
Sm
+ |
Eu
+ |
Gd
+ |
Tb
+ |
Dy
+ |
Ho
+ |
Er
+ |
Tm
+ |
Yb
+ |
Lu
+ |
**
|
Ac
|
Th
+ |
Pa
+ |
U
+ |
Np
|
Pu
+ |
Am
+ |
Cm
+ |
Bk
+ |
Cf
+ |
Es
|
Fm
|
Md
+ |
No
|
Lr
|
- : Bereits seit prähistorischer Zeit bekannt.
- S: Bereits seit prähistorischer Zeit bekannt, sein Elementcharakter wurde vermutlich erstmals von Lavoisier erkannt.
- Zn: Seit ungefähr 1300 v.Chr. in China verarbeitet.
- Sb: Neuere Funde belegen die Nutzung von Antimon durch die Völker Mesopotamiens seit ungefähr 4000 Jahren.
- Hg: Ungefähr seit 3000 Jahren bekannt.
- Np - Uuo: Die hier als Entdecker der Transurane angegebenen
Personen stehen jeweils stellvertretend für die beteiligten
Forschergruppen am Vereinigten Institut für Kernforschung in Dubna, am Lawrence Berkeley National Laboratory in Berkeley, am CERN in Genf und der GSI in Darmstadt.
Siehe auch
- Elektronenkonfiguration im Periodensystem
- Liste der chemischen Elemente nach: Namen
- Etymologische Liste der chemischen Elemente
- Seltenheit
- Atom
- Liste der Isotope
Ich bedanke mich für Ihre große Interesse an Periodensystem.
|
 Periodensystem
Periodensystem  Periodensystem
Periodensystem